مقررات ابزارهای تشخیصی آزمایشگاهی(IVDR)
فهرست مطالب:
IVDR (Regulation (EU) 2017/746) چیست؟
ویژگی های کلیدی IVDR
الزامات تجهیزات تشخیصی آزمایشگاهی (IVDR) چیست؟
IVDR (Regulation (EU) 2017/746) مقررات نظارتی است که اتحادیه اروپا برای کنترل تولید بازاریابی و استفاده از ابزارهای تشخیصی آزمایشگاهی (IVD) تدوین کرده است. تجهیزات تشخیصی آزمایشگاهی (IVD) تجهیزاتی هستند که برای آزمون روی نمونههایی مانند خون ادرار بافت و سایر مایعات بدن استفاده میشوند.
در سال ۲۰۱۷ مقررات تجهیزات پزشکی IVDR توسط پارلمان و شورای اتحادیه اروپا تصویب شده و جایگزین دستوالعمل قبلی (IVDD) شد. کلیه تولیدات در حوزه ابزارهای تشخیصی آزمایشگاهی (IVD) برای فعالیت در کشورهای اروپایی و اخذ نشان CE موظف اند تا الزامات ذکر شده در مقررات IVDR را رعایت نمایند. اگر در حوزه تجهیزات تشخیصی آزمایشگاهی (IVD) فعال هستید و قصد صادرات محصولات خود را دارید لازم است تا در قدم نخست با الزامات IVDR آشنا شده و در راه رعایت این الزامات قدم بردارید تا مسیر شما برای اخذ نشان CE هموار گردد.

ویژگی های کلیدی IVDR

طبقه بندی ابزارهای تشخیصی آزمایشگاهی
طبق مقررات IVDR تمامی تجهیزات تشخیصی آزمایشگاهی (IVD) برمبنای سطح خطر در چهارکلاس A,B,C,D قرار می گیرند.
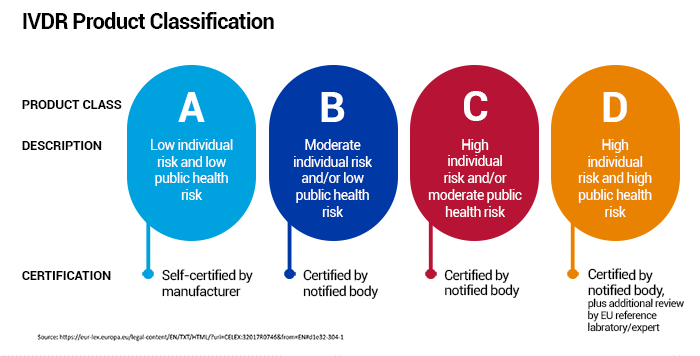

ارزیابی تطابق ابزارهای تشخیصی آزمایشگاهی IVDR
تمام تولید کنندگان تجهیزات تشخیصی آزمایشگاهی (IVD) باید از مرحله ارزیابی تطابق عبور کنند. ارزیابی تطابق توسط سازمان های اعلام شده اتحادیه اروپا (NB: Notified Body) برای بررسی سازگاری تولید کنندگان با الزامات IVDR صورت می پذیرد.

شناسه منحصر به فرد دستگاه (UDI)
مقررات تجهیزات پزشکی IVDR سیستم شناسایی منحصر به فرد دستگاه را برای شناسایی و رهگیری دستگاه ها معرفی می کند. طبق این سیستم تمام دستگاه ها دارای کد منحصر به فردی هستند که ردیابی محصول را بهبود می بخشد.

نظارت پس از بازار (PMS: Post Market Surveillance)
الزامات IVDR روی انجام نظارت پس از بازار توسط تولیدکنندگان تأکید دارد. هدف از این فعالیتها کنترل عملکرد ایمنی و فواید بالینی تجهیزات تشخیصی آزمایشگاهی (IVD) است.
شرکت راهبراندیشان صنعت راد، به همراه تیم حرفهایاش در خصوص اجرای الزامات پیش نیاز اخذ نشان CE برای فعالیت در کشورهای اروپایی، پاسخگوی سؤالات شما میباشد.

